爲培育自治區乳酸菌粉産業發展,規範乳酸菌粉生(shēng)産許可審查工(gōng)作,依據《中(zhōng)華人民共和國食品安全法》《食品生(shēng)産許可管理辦法》《食品生(shēng)産許可審查通則》及相關食品安全國家标準等規定,結合自治區實際,自治區市場監督管理局起草了《新疆維吾爾自治區乳酸菌粉食品生(shēng)産許可審查方案(試行)(征求意見稿)》。現公開(kāi)向社會各界征求意見建議,歡迎各有關單位、社會團體(tǐ)、個人提出修改意見,并于2024年2月5日前反饋自治區市場監督管理局行政審批處。
聯系人:馬丹陽
聯系電(diàn)話(huà):0991-2825858
郵箱:madanyang@xjaic.gov.cn
新疆維吾爾自治區市場監督管理局
2024年1月23日
新疆維吾爾自治區乳酸菌粉食品生(shēng)産許可審查方案
第一(yī)章 總 則
第一(yī)條 爲加強食品生(shēng)産許可管理,規範乳酸菌粉生(shēng)産許可審查工(gōng)作,依據《中(zhōng)華人民共和國食品安全法》及其實施條例、《食品生(shēng)産許可管理辦法》《食品生(shēng)産許可審查通則》(以下(xià)簡稱“審查通則”)等有關法律法規、規章及國務院衛生(shēng)行政部門公告和相關食品安全國家标準的規定,結合新疆維吾爾自治區食品生(shēng)産許可審查實際,制定本方案(以下(xià)簡稱“方案”)。
第二條 本方案所稱乳酸菌粉是指使用國務院衛生(shēng)行政部門公布的《可用于食品的菌種名單》中(zhōng)的乳酸菌種,經接種活化、發酵培養、濃縮、幹燥、粉碎或不粉碎、調配或不調配、包裝等工(gōng)序制成的粉狀或顆粒狀産品。片(塊)、液體(tǐ)等其他狀态産品可參照本方案執行。
第三條 乳酸菌粉的申證類别爲其他食品,類别編号爲3101,生(shēng)産許可證副頁須注明品種明細爲:其他食品(乳酸菌粉)。 第四條 本方案應與《審查通則》結合使用,适用于區域内乳酸菌粉食品生(shēng)産許可審查工(gōng)作。僅有包裝場地、工(gōng)序、設備,沒有完整的生(shēng)産條件,不予生(shēng)産許可審查。
第五條 本方案中(zhōng)引用的文件、标準通過引用成爲本方案的内容。凡是引用文件、标準,其最新版本(包括所有的修改單)适用于本方案。
第二章 生(shēng)産場所
第六條 生(shēng)産企業廠房選址和設計、内部建築結構應當符合《審查通則》及《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881)的相關要求。
第七條 生(shēng)産車(chē)間種類、布局應與産品特性、生(shēng)産工(gōng)藝和生(shēng)産能力相适應。生(shēng)産車(chē)間一(yī)般包括活化擴培間、稱量配料間、發酵車(chē)間、離(lí)心濃縮車(chē)間、冷凍幹燥車(chē)間、調配混合車(chē)間(如需)、粉碎車(chē)間(如需)、内包裝車(chē)間及外(wài)包裝車(chē)間等。
第八條 廠房和車(chē)間根據生(shēng)産工(gōng)藝和清潔程度要求通常可劃分(fēn)爲清潔作業區、準清潔作業區和一(yī)般作業區,不同作業區應有效分(fēn)隔,避免交叉污染。各作業區具體(tǐ)劃分(fēn)見下(xià)表。
乳酸菌粉生(shēng)産車(chē)間及清潔作業區劃分(fēn)表
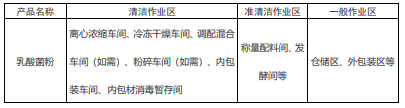
原始種子制作、标準凍存管制作及試管水平、三角瓶水平種子的活化擴培操作必須在實驗室超淨工(gōng)作台或者在潔淨區内的超淨工(gōng)作台完成。
第九條 清潔作業區的出入應有合理的限制和控制,清潔作業區、準清潔作業區的對外(wài)出入口應安裝能自動關閉(如自動感應器或閉門器等)的門和(或)空氣幕,并應确保兩側的門不被同時開(kāi)啓。應設置原輔料包裝清潔設施和包裝材料清潔消毒設施。清潔作業區應保持幹燥,并盡量減少供水設施及系統,如無法避免,應有相應防護措施。
第十條 清潔區空氣潔淨度達到10萬級(符合GB 50687食品工(gōng)業潔淨用房建築設計規範中(zhōng)Ⅲ級相關要求)。企業的質量檢驗機構應定期對清潔作業區進行空氣質量監測,每年進行一(yī)次檢測,并有第三方的檢測報告。
第十一(yī)條 庫房應當符合《審查通則》及《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881)的相關要求。貯存乳酸菌菌株及産品應具備相應的制冷設備或設施,以滿足産品的貯存要求。
第三章 設備設施
第十二條 生(shēng)産設備應符合《審查通則》的相關要求。乳酸菌粉生(shēng)産設備一(yī)般包括:活化擴培設備、前處理設備(如純化水設備、配料罐)、發酵設備、離(lí)心濃縮設備、冷凍幹燥設備、粉碎設備(如需)、調配混合設備(如需)、包裝設備、異物(wù)控制設備。
第十三條 主要物(wù)料的固定管道設施應标明内容物(wù)名稱和流向。用于測定、控制、記錄的監控設備,如壓力表、溫度計等,應定期校準、維護,确保準确有效。
第十四條 供排水、清潔消毒、廢棄物(wù)存放(fàng)、個人衛生(shēng)、通風、照明、溫控、檢驗設備等設施應當符合《審查通則》及《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881)的相關要求。
第十五條 生(shēng)産車(chē)間入口處應設置更衣室,配置換鞋(鞋套)及(或)工(gōng)作鞋靴消毒設施。更衣室應保證工(gōng)作服與個人服裝及其他物(wù)品分(fēn)開(kāi)放(fàng)置,應配置足夠數量的非手動式洗手設施、消毒設施;必要時設置冷熱水混合器。要在臨近洗手設施的顯著位置标示簡明易懂的洗手方法,并設置幹手設施。清潔作業區入口應設置二次更衣區,洗手、幹手和(或)消毒設施,換鞋(穿戴鞋套)或工(gōng)作鞋靴消毒設施。
第十六條 産品自行檢驗的,企業應當按照産品執行标準及檢驗管理制度中(zhōng)規定配備滿足原料、半成品、成品檢驗所需的檢驗設備設施。包括但不限于:分(fēn)析天平(0.1mg)、天平(0.1g)、幹燥箱、恒溫培養箱、無菌室或超淨工(gōng)作台、滅菌鍋、生(shēng)物(wù)顯微鏡、恒溫水浴鍋等。
第四章 設備布局與工(gōng)藝流程
第十七條 生(shēng)産設備的布局與工(gōng)藝流程應符合《審查通則》的相關要求。
第十八條 乳酸菌粉基本工(gōng)藝流程如下(xià):
菌種活化→配料→發酵→離(lí)心濃縮→冷凍幹燥→粉碎或不粉碎→調配或不調配→包裝具體(tǐ)産品按企業實際工(gōng)藝流程生(shēng)産,但其工(gōng)藝流程必須科學合理、符合相關規定。
第十九條 生(shēng)産企業應當根據産品特性、質量要求、風險控制等因素,通過危害分(fēn)析方法應對生(shēng)産過程中(zhōng)的質量安全關鍵控制環節進行控制,監控并記錄各項指标。關鍵工(gōng)序或關鍵點可設爲:原輔料驗收、菌種活化、發酵、冷凍幹燥、包裝。
第五章 人員(yuán)管理
第二十條 人員(yuán)要求、人員(yuán)培訓、人員(yuán)健康管理制度應當符合《審查通則》及《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881)的相關要求。
第二十一(yī)條 企業應設置獨立的食品質量安全管理機構,按照《企業落實食品安全主體(tǐ)責任監督管理規定》的要求,配備專職的食品安全總監、食品安全員(yuán)等食品安全管理人員(yuán),并制定《食品安全總監職責》《食品安全員(yuán)守則》,建立、實施和持續改進食品安全管理制度,确保各項制度落實到位。
第二十二條 企業應建立人員(yuán)管理制度,各崗位人員(yuán)的數量和能力應與企業規模、工(gōng)藝、設備水平相适應。
第六章 管理制度
第二十三條 采購管理及進貨查驗記錄制度應當符合《審查通則》及《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881)的相關要求,并根據原料特性、風險因素等制定原輔料的進貨檢驗(或驗收)标準、程序和判定原則,保證使用的原輔料、食品添加劑、食品相關産品符合法律法規和食品安全标準的要求。
第二十四條 制定原輔料供應商(shāng)審核制度,定期對主要原料供應商(shāng)進行評價、考核,确定合格供應商(shāng)名單。主要原輔料供應商(shāng)、貿易商(shāng)應相對固定并簽訂質量協議,在協議中(zhōng)應明确雙方所承擔的質量責任。原輔料供應商(shāng)的審核至少應包括:供應商(shāng)的資(zī)質證明文件、質量标準、檢驗報告。采用進口原輔料的生(shēng)産企業,應審核進口原輔料供應商(shāng)、貿易商(shāng)的資(zī)質證明文件、質量标準、每批原輔料出入境檢驗檢疫部門出具的相關合格證明。
第二十五條 生(shēng)産過程控制制度應當符合《審查通則》及《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881)的相關要求。
應建立乳酸菌菌種鑒定、保存、使用及銷毀處理制度。使用的原始菌種應符合國務院衛生(shēng)行政部門最新公布的《可用于食品的菌種名單》和相關法律法規的要求,具有菌種來源證明或相應的菌種鑒定報告。
菌種活化應嚴格控制活化時間、活化後OD值。
發酵應嚴格按工(gōng)藝要求操作,嚴格控制培養基成分(fēn)、發酵溫度,防止雜(zá)菌污染。
幹燥工(gōng)藝應嚴格監控溫度、時間等工(gōng)藝參數,對工(gōng)藝參數進行監控并記錄。
包裝工(gōng)藝應設置異物(wù)控制措施,按照淨含量要求定量包裝,封口後對産品外(wài)觀、淨含量、密封狀況進行檢查。
第二十六條 應制定下(xià)列檢驗管理制度:
(一(yī))建立原輔料檢驗管理制度。規定食品原輔料、食品添加劑和食品相關産品的進貨檢驗(或驗收)标準、程序和判定準則。
(二)建立半成品檢驗管理制度。應建立乳酸菌粉過程檢驗制度,包括從原始種子批到傳代、擴增後保存的工(gōng)作種子批應逐批檢驗并建立使用、保存和檢驗記錄制度;對生(shēng)産過程中(zhōng)的原始凍存管、種子液、發酵液等物(wù)料及中(zhōng)間單菌株産品逐批有效驗證和确認。
(三)建立成品出廠檢驗管理制度。成品出廠檢驗應綜合考慮産品特性、工(gōng)藝特點、原料控制情況等因素合理确定檢驗項目和檢驗頻(pín)次,并符合執行标準的規定。成品須經出廠檢驗合格後方可銷售。
(四)出廠自行檢驗的,應當定期與具有合法資(zī)質的檢驗機構對出廠項目進行能力比對或驗證,并符合相應的檢驗要求;不能自行檢驗的,應當委托具有合法資(zī)質的檢驗機構進行檢驗,并出具檢驗報告。
(五)企業可以使用快速檢測方法進行出廠檢驗,但應保證檢測結果準确,應定期與國家标準規定的檢驗方法比對或驗證。當快速檢驗方法檢驗結果顯示異常時,應使用國家标準規定的檢驗方法進行确認。
(六)産品留樣間應滿足産品貯存條件要求,留樣數量應滿足複檢要求,産品留樣應保存至保質期滿,并有記錄。
第二十七條 應建立出廠檢驗記錄制度、運輸和交付管理制度、食品安全追溯管理體(tǐ)系、食品安全自查制度、不合格品管理制度及不安全食品召回制度、食品安全事故處置方案等,并符合相關要求。
第二十八條 企業應當根據食品安全法律、法規、規章、标準和有關規定,建立但不限于下(xià)列食品安全管理制度和要求:
(一(yī))應當建立日管控、周排查、月調度等風險管控制度。企業應當建立基于食品安全風險防控的動态管理機制,充分(fēn)進行食品安全風險分(fēn)析,建立并不斷完善食品安全風險管控清單,按照《企業落實食品安全主體(tǐ)責任監督管理規定》的規定建立健全日管控、周排查、月調度工(gōng)作制度和機制。
(二)應建立衛生(shēng)管理制度。包括食品加工(gōng)人員(yuán)和食品生(shēng)産衛生(shēng)管理制度、清潔消毒制度和清潔消毒用具管理制度、工(gōng)作服清洗制度。保證生(shēng)産場所、生(shēng)産設備、包裝容器、工(gōng)作服和人員(yuán)的清潔衛生(shēng)和安全,防止産品在生(shēng)産過程中(zhōng)被污染。
(三)應建立清場管理制度。各生(shēng)産工(gōng)序在生(shēng)産結束後更換品種或批次前,應當對現場進行清場并進行記錄。清場工(gōng)作包括剩餘物(wù)料的處理,中(zhōng)間品、成品的處理,廢棄物(wù)的處理,生(shēng)産用具的處理,外(wài)包工(gōng)序的清場。記錄内容包括:工(gōng)序、品名、生(shēng)産批次、清場時間、檢查項目及結果等,清場負責人及複查人應當在記錄上簽名。
(四)按照《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881),建立防止生(shēng)物(wù)污染、化學污染、物(wù)理污染的控制制度,有效防止産品在生(shēng)産加工(gōng)中(zhōng)的污染、損壞或變質。
(五)應制定設備故障、停電(diàn)停水等特殊原因中(zhōng)斷生(shēng)産時的産品處置辦法,保證對不符合标準的産品按不合格産品處置。當進行現場維修、維護及施工(gōng)等工(gōng)作時,應采取适當措施避免異物(wù)、異味、碎屑等污染食品。
(六)參照《食品安全國家标準 食品生(shēng)産通用衛生(shēng)規範》(GB 14881)附錄《食品加工(gōng)過程的微生(shēng)物(wù)監控程序指南(nán)》,對食品加工(gōng)過程的微生(shēng)物(wù)進行監控,合理設置衛生(shēng)監控要求。
(七)應建立食品标簽審核制度。産品标簽應當符合法律法規、食品安全标準等規定,并應按照國務院衛生(shēng)行政部門公告的規定進行标注。
(八)應建立記錄和文件管理制度。如實記錄從原料采購、加工(gōng)、檢驗、貯存、運輸、銷售各環節信息。對文件進行有效管理,确保各相關場所使用的文件均爲有效版本。
第七章 試制産品檢驗
第二十九條 企業應提交符合産品執行的食品安全标準、産品标準和國務院衛生(shēng)行政部門公告的試制産品檢驗合格報告。
第八章 附 則
第三十條 本方案由新疆維吾爾自治區市場監督管理局負責解釋。
第三十一(yī)條 本方案自發布之日起30日後實施,有效期5年。
第三十二條 國家市場監督管理總局發布相關文件規定後,本方案自行廢止。
 京公網安備11010502045875
京公網安備11010502045875